Ionenbindung
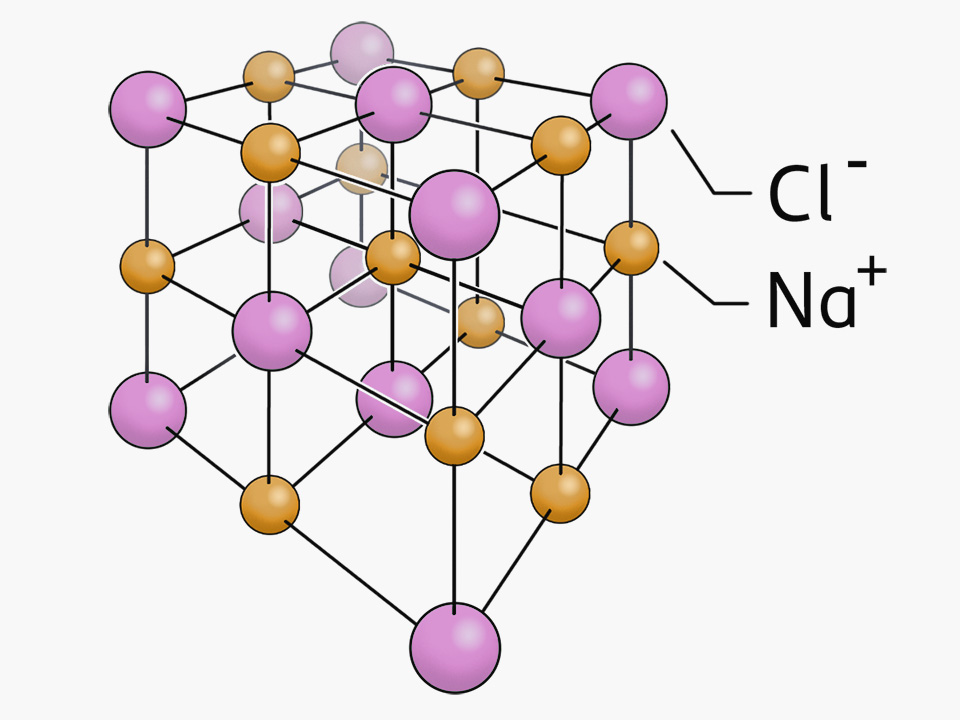
Die Ionenbindung führt zur Bildung von Salzen. Ein bekanntes Salz ist Natriumchlorid, das für uns lebensnotwendige Kochsalz. Salzformeln verweisen auf den Aufbau der Kristallgitter von Salzen.
Info für Lehrende
Mehr zu SchuBu+
Grundlagen
Bei der Ionenbindung geben Metallatome ihre Außenelektronen an Nichtmetallatome ab. Durch die Elektronenabgabe bilden sich Metall-Kationen (positiv geladen). Durch die Elektronenaufnahme der Nichtmetallatome bilden sich Nichtmetall-Anionen (negativ geladen). Aufgrund der unterschiedlichen Ladungen von Kationen und Anionen ziehen sich diese durch elektrostatische Wechselwirkungen an.
Ladung von Ionen
Ladung von Kationen
Metall-Atome geben ihre Außenelektronen ab, um eine volle Außenschale zu erreichen. Die dadurch positiv geladenen Ionen nennt man Kationen.
Die positive Ladung des Kations entspricht der Anzahl der abgegebenen Elektronen:
Magnesium aus der 2. Gruppe hat zwei Außenelektronen und gibt beide ab.
Die Protonen im Kern sind in der Überzahl – die Ladung des Ions ist somit 2+ (man schreibt: Mg$$^{2+}$$).
Ladung von Anionen
Nichtmetall-Atome nehmen Elektronen auf, um eine volle Außenschale zu erreichen. Die dadurch negativ geladenen Ionen nennt man Anionen.
Die negative Ladung des Anions entspricht der Anzahl der aufgenommenen Elektronen: Sauerstoff aus der 16. Gruppe hat 6 Außenelektronen und nimmt noch 2 auf. Die Ladung der Ionen ist daher 2- (O$$^{2-}$$).
Anzahl der Außenelektronen minus 8.
Salze und Salzformeln
Durch die elektrostatische Anziehung zwischen Kationen und Anionen entstehen regelmäßige Gitter, die als Kristallgitter oder Ionengitter bezeichnet werden. Es entstehen Salze. Diese sind nach außen hin ungeladen, das bedeutet, dass in einem Kristallgitter immer gleich viele positive wie negative Ladungen vorliegen.
Die Salzformel für Natriumchlorid ist NaCl. In dieser Formel wird das Ionenverhältnis im Kristallgitter angegeben. Man spricht daher auch von Verhältnisformeln. Bei Natriumchlorid sind die Natrium-Ionen einfach positiv geladen und die Chlorid-Ionen einfach negativ geladen. Somit besteht das Ionengitter aus gleich vielen Natrium-Ionen wie Chlorid-Ionen, es liegt das Ionenverhältnis 1:1 vor.

Aufstellen von Salzformeln und Salznamen
- Das (Metall) wird immer vor dem (Nichtmetall) angeführt: ().
- Metall-Kationen tragen den Namen des Elements (
z. B. ). - Kommt nur eine Sorte an Nichtmetallen im Salz vor, so endet der Name des Anions mit „id“: .
- Besteht das Anion aus mehreren Atomsorten (zusammengesetztes Anion), so erhält dieses einen eigenen Namen: ().
- In der Salzformel müssen immer gleich viele positive wie negative Ladungen vorkommen (
d. h. Salze sind nach außen hin ungeladen). - Es muss das einfachste Ionenverhältnis angegeben werden (), nicht: Mg2Cl4.
| Anion | Ladung | Bezeichnung | Beispiel |
|---|---|---|---|
| F$$^{-}$$ | 1- | Fluorid | Natriumfluorid (NaF) |
| Cl$$^{-}$$ | 1- | Chlorid | Magnesiumchlorid (MgCl$$_2$$) |
| Br$$^{-}$$ | 1- | Bromid | Kaliumbromid (KBr) |
| I$$^{-}$$ | 1- | Iodid | Calciumiodid (CaI$$_2$$) |
| O$$^{2-}$$ | 2- | Oxid | Lithiumoxid (Li$$_2$$O) |
| S$$^{2-}$$ | 2- | Sulfid | Rubidiumsulfid (Rb$$_2$$S) |
| N$$^{3-}$$ | 3- | Nitrid | Aluminiumnitrid (AlN) |
| P$$^{3-}$$ | 3- | Phosphid | Calciumphosphid (Ca$$_3$$P$$_2$$) |
| Anion | Ladung | Bezeichnung | Beispiel |
|---|---|---|---|
| NO$$_{3}$$$$^{-}$$ | 1- | Nitrat-Ion | Kaliumnitrat (KNO$$_3$$) |
| NO$$_2$$$$^{-}$$ | 1- | Nitrit-Ion | Natriumnitrit (NaNO$$_2$$) |
| CO$$_3$$$$^{2-}$$ | 2- | Carbonat-Ion | Magnesiumcarbonat (MgCO$$_3$$) |
| SO$$_4$$$$^{2-}$$ | 2- | Sulfat-Ion | Calciumsulfat (CaSO$$_4$$) |
SALZ-O-MAT
Kannst du mit diesem Wissen jetzt selber Salze zusammenbauen? Probiere es aus!Eigenschaften von Salzen
Salze liegen bei Raumtemperatur als harte, spröde Feststoffe vor. Ihre Schmelzpunkte sind vergleichsweise hoch, da aufgrund der Gitterenergie (die für den Zusammenhalt der Ionen im Kristallgitter sorgt) beim Schmelzen entsprechend viel Energie aufgebracht werden muss. Diese Gitterenergie wird bei den meisten Salzen beim Lösen in Wasser überwunden, weshalb die meisten Salze gut wasserlöslich sind.

Eine elektrische Leitfähigkeit liegt bei einer Substanz vor, wenn diese frei bewegliche, geladene Teilchen besitzt. Daher sind Salze als Feststoff nicht leitend. In Wasser gelöste Salze (Lösungen) oder Schmelzen von Salzen leiten jedoch Strom.
Überlege, warum Leitungswasser Strom leitet!
Reines Wasser ist kein guter elektrischer Leiter, weil darin fast keine geladenen Teilchen vorliegen. Im Leitungswasser sind Salze gelöst (diese sorgen auch für die Mineralstoffversorgung unseres Körpers!), die für die Leitfähigkeit des Leitungswassers verantwortlich sind.
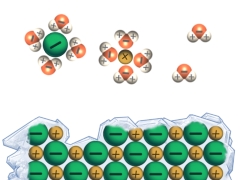
Bindungsarten und -eigenschaften
Die charakteristischen Eigenschaften von Stoffen lassen sich mit deren Strukturen begründen. Lerne hier die Bindungsarten und die Eigenschaften der verschiedenen Bindungstypen noch genauer kennen!Kaliumiodid-Tabletten (Ionen: K$$^{+}$$, I$$^{-}$$) liegen in Schulen für den Ernstfall bereit: kommt es zu einem Reaktorunfall, werden diese eingenommen, damit die Schilddrüse über die Atmung aufgenommenes, radioaktives Iod ($$^{131}$$I) nicht einbaut. So wird sie vor strahlenbedingtem Schilddrüsenkrebs geschützt.

