Elektronenpaarbindung
Die Elektronenpaarbindung (Atombindung, kovalente Bindung) liegt zwischen Nichtmetallatomen vor. Dabei werden Elektronen der Außenschale geteilt, es bilden sich Elektronenpaare. Dadurch entstehen Moleküle.
Info für Lehrende
Mehr zu SchuBu+
Grundlagen
Bei der Elektronenpaarbindung nähern sich Nichtmetallatome so weit an, dass sie Elektronen gemeinsam nutzen können. Es entstehen Elektronenpaare, die Bindungen zwischen den Atomen bilden und die dadurch beiden Atomen zugeordnet werden. So wird die Edelgasregel erfüllt: in der Darstellung kannst du sehen, dass jedes Chloratom in der Außenschale 8 Außenelektronen hat.
Die durch Elektronenpaarbindung entstehenden Strukturen nennt man Moleküle.
Molekulare Elemente
Nichtmetalle (außer Edelgase) kommen auf der Erde ausschließlich als molekulare Elemente (
Eigenschaften
Aufgrund der vielen Kombinationsmöglichkeiten an Nichtmetallatomen gibt es eine Vielzahl an Molekülen. Im Vergleich zu Salzen und Metallen haben molekulare Stoffe meist niedrige Schmelz- und Siedetemperaturen. Die meisten molekularen Stoffe sind elektrisch nicht leitend. Viele liegen bei Raumtemperatur als gasförmige oder flüssige Substanzen vor. Stoffe aus besonders großen Molekülen sind Feststoffe.


Die physikalischen Eigenschaften von Molekülen hängen auch von der Elektronenverteilung innerhalb des Moleküls und den daraus resultierenden Wechselwirkungen zwischen den Molekülen ab.
Unpolar und polar
Bei der Elektronenpaarbindung unterscheidet man, abhängig von den Bindungspartnern, zwei Formen: die unpolare und die polare Elektronenpaarbindung.
Unpolare Elektronenpaarbindung
Besteht ein Molekül aus Atomen des gleichen Elements
Polare Elektronenpaarbindung
Besteht ein Molekül aus Atomen unterschiedlicher Elemente wie zum Beispiel bei Fluorwasserstoff (HF), so wird das geteilte Elektronenpaar von den 9 Protonen des Fluor-Atoms stärker angezogen als von dem einen Proton des Wasserstoffatoms.
Dadurch kommt es zu einer Ladungsverschiebung, bei der sich die geteilten Elektronen zum Fluor-Atom hin ausrichten. Da Elektronen negativ geladen sind, bildet sich am F-Atom eine negative Teilladung (delta minus, δ-) und am H-Atom eine positive Teilladung (delta plus, δ+).
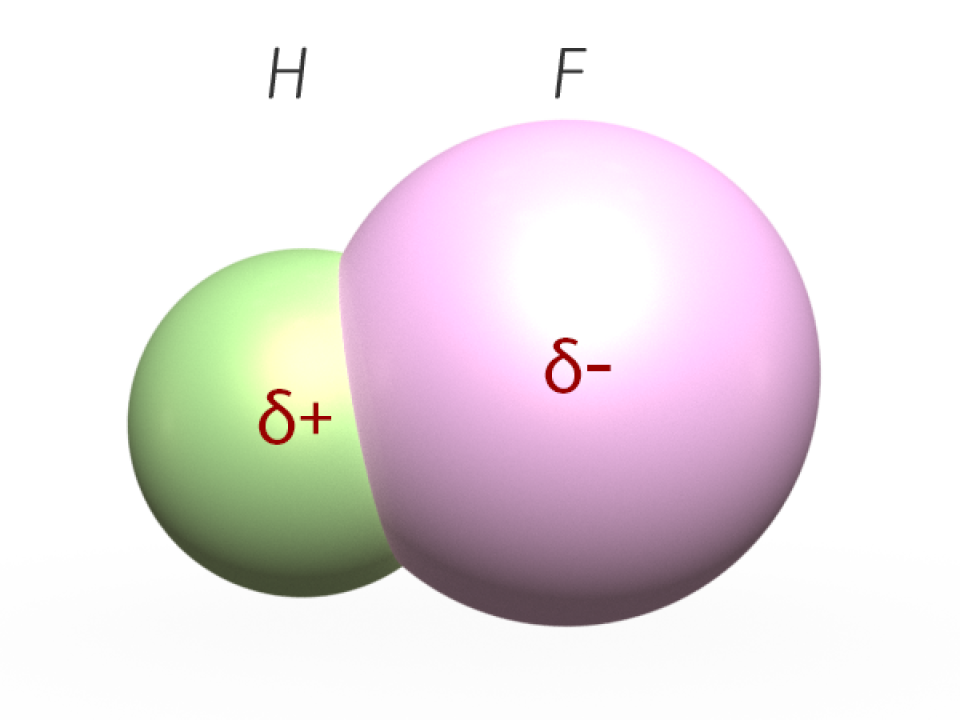
Im Molekül entstehen ein negativ geladener und ein positiv geladener Pol (Dipol), vergleichbar mit einem Magneten. Die positiven und die negativen Teilladungen der Moleküle ziehen einander an, man spricht von Dipol-Dipol-Wechselwirkungen.

Wasser – ein besonderer Dipol
Wasser ist ein Beispiel für einen Dipol, der in unserem Alltag eine wichtige Rolle spielt. Im Wassermolekül liegt ein negativer Ladungsüberschuss (δ-) auf der Seite des Sauerstoffatoms vor. An der Seite der Wasserstoffatome bilden sich dadurch positive Teilladungen (δ+). Auch die gewinkelte Struktur des Wassermoleküls führt zu seinen besonderen Eigenschaften.
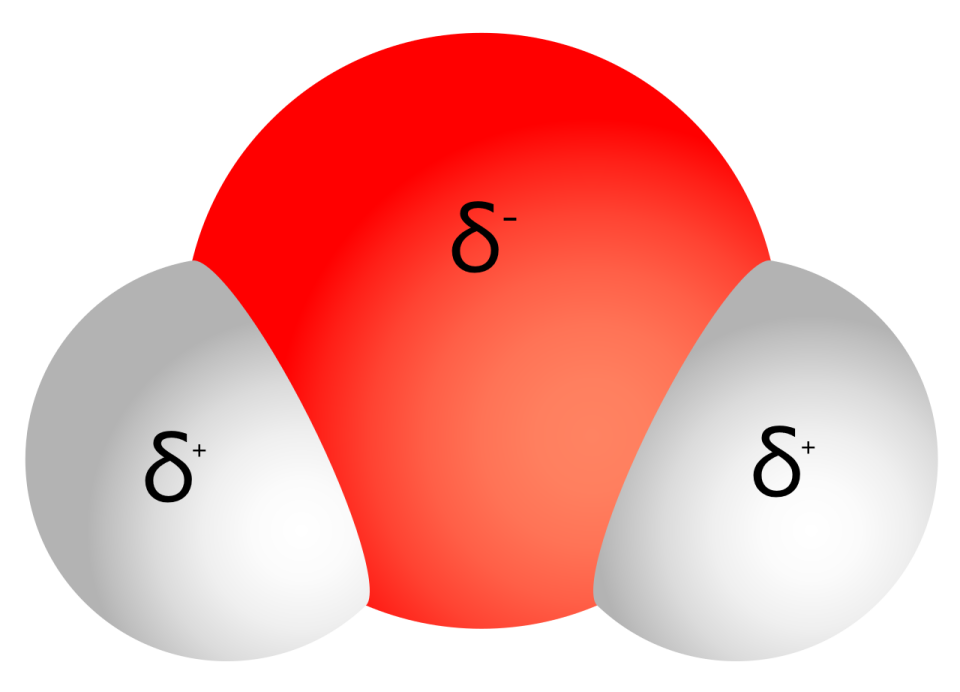
Bei Wasser liegen besonders starke Dipol-Dipol-Wechselwirkungen vor. Die starke Anziehung der unterschiedlichen Teilladungen der Wassermoleküle führt zur Ausbildung von Wasserstoff-Brücken.
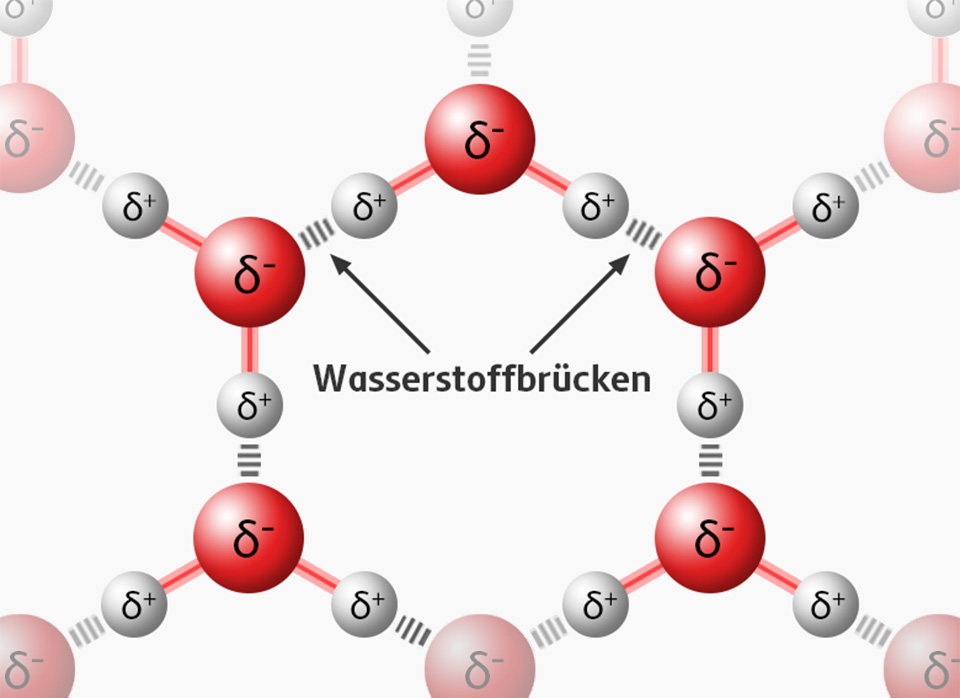
Wassermoleküle wechselwirken auch mit anderen Dipolen, geladenen Teilchen (Ionen) oder elektrisch geladenen Strukturen.
Wasser als Lösungsmittel
Wasser ist ein sehr gutes Lösungsmittel für viele feste, flüssige und gasförmige Stoffe. Dies spielt in vielen Bereichen eine wichtige Rolle: Nährstoffe lösen sich in unserem Blut, verschmutzte Kleidung wird wieder sauber, Speisen können zubereitet werden, Fische atmen den im Wasser gelösten Sauerstoff. Auch viele Salze lösen sich gut in Wasser.


Die Löslichkeit von Stoffen hängt von ihrer Polarität ab. Polare Moleküle (Dipole) und Salze (ihre Bausteine, die Ionen, sind geladen) lösen sich gut in polaren Lösungsmitteln wie Wasser. Unpolare Stoffe lösen sich in unpolaren Lösungsmitteln.
Zur Löslichkeit von Stoffen kann man sich daher folgenden Grundsatz merken:
Stoffe, die sich gut in Wasser lösen (
Lerne die Löslichkeit von Wasser mit folgenden Experimenten noch genauer kennen!
Physikalische Eigenschaften
Aufgrund der Wasserstoff-Brücken hat Wasser viel höhere Schmelz- und Siedepunkte als Substanzen aus vergleichbaren Molekülen. Methan (CH4) hat eine ähnliche Molekülmasse wie Wasser, Schwefelwasserstoff (H2S) ist sehr ähnlich gebaut wie Wasser (siehe Abb.) – dennoch sind CH4 und H2S bei Raumtemperatur gasförmig. Der Grund dafür, dass Wasser bei Raumtemperatur flüssig ist, liegt darin, dass für das Lösen der Wasserstoff-Brücken zusätzlich Energie notwendig ist – daher hat Wasser höhere Schmelz- und Siedetemperaturen.
| Schmelzpunkt | Siedepunkt | |
|---|---|---|
| Wasser (H2O) | 0 °C | 100 °C |
| Methan (CH4) | -182 °C | -162 °C |
| Schwefelwasserstoff (H2S) | -85,7 °C | -60,2 °C |






