Das Periodensystem der Elemente
Das heute gebräuchliche Periodensystem der Elemente (PSE) entwickelte sich aus den Entwürfen von Dimitri Mendelejew und Lothar Meyer (1869). Mit Hilfe des PSE erfährt man einfach und übersichtlich Informationen zu den Eigenschaften von Elementen und zum Bau der Atome.
Info für Lehrende
Mehr zu SchuBu+
Grundlagen des Periodensystems
Das PSE ist nach steigender Ordnungszahl (Protonenzahl) der Elemente gereiht. Weiters wird bei der Anordnung der Bau der Elektronenhülle der Atome berücksichtigt. Die Elemente werden mit internationalen Elementsymbolen abgekürzt, wie zum Beispiel N für Stickstoff.
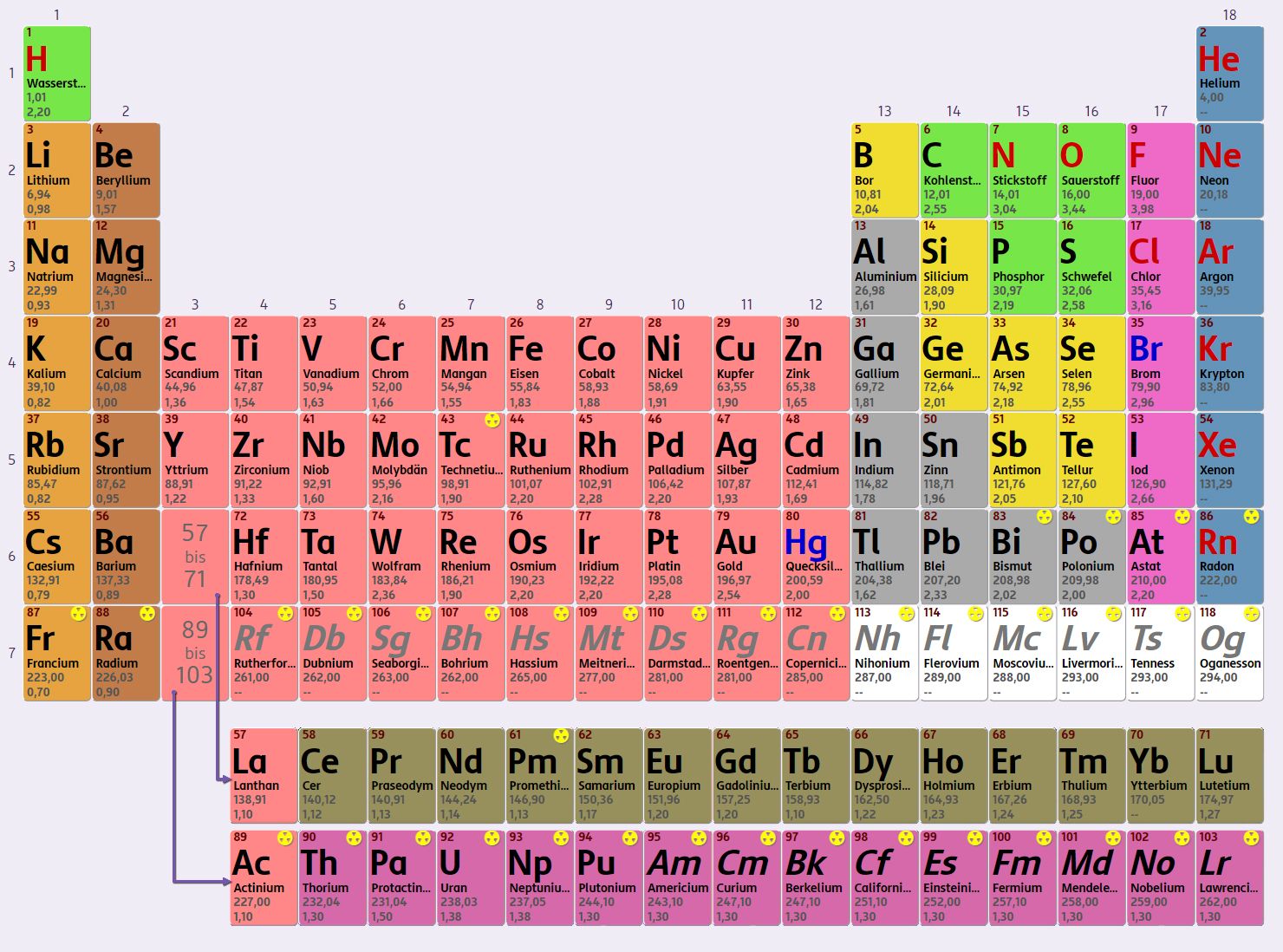

Interaktives Periodensystem der Elemente
Möchtest du die Elemente genauer kennenlernen? Du findest sie im Periodensystem der Elemente!Elementsymbole im Periodensystem
Bereits im frühen Mittelalter hat man für chemische Elemente Symbole entwickelt, um Experimente und deren Ergebnisse zu notieren. Im Laufe der Jahrhunderte machte man sich viele Gedanken zur vereinfachten Darstellung von Elementen.
Auch John Dalton (um 1800) hatte sich für jedes Element ein Symbol überlegt – Verbindungen stellte er als Kombinationen dieser Elementsymbole dar. Dieses System wurde aber rasch sehr kompliziert und unübersichtlich.
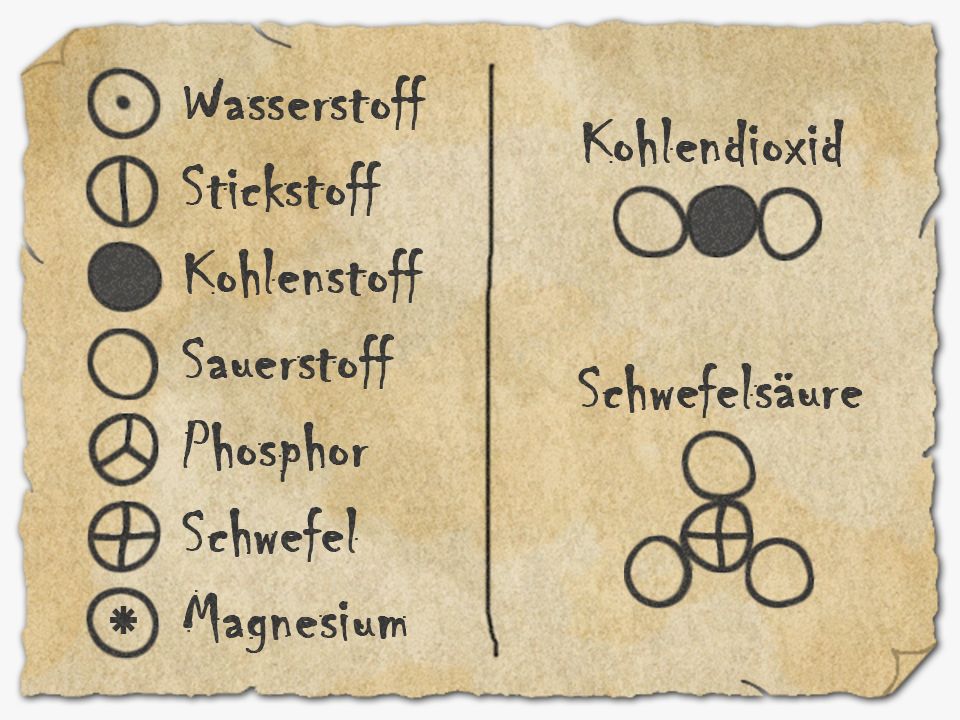
Mit der Entstehung der modernen Chemie und dem Austausch von Informationen mit anderen Ländern hat man eine international anerkannte Symbolsprache festgelegt. Wie im Periodensystem der Elemente ersichtlich, wird heute jedes chemische Element mit einem international gültigen Symbol abgekürzt, welches aus einem oder zwei Buchstaben besteht. Dabei wird der erste Buchstabe immer groß, der zweite (falls vorhanden) immer klein geschrieben. Viele Symbole leiten sich von den lateinischen oder griechischen Namen der Elemente ab.
| Symbol | Bezeichnung | Herkunft |
|---|---|---|
| H | Wasserstoff | hydrogenium (griech.) |
| C | Kohlenstoff | carbo (lat.) |
| N | Stickstoff | nitrogenium (griech.) |
| O | Sauerstoff | oxygenium (griech.) |
| S | Schwefel | sulfur (lat.) |
| Fe | Eisen | ferrum (lat.) |
| Ag | Silber | argentum (lat.) |
| Au | Gold | aurum (lat.) |
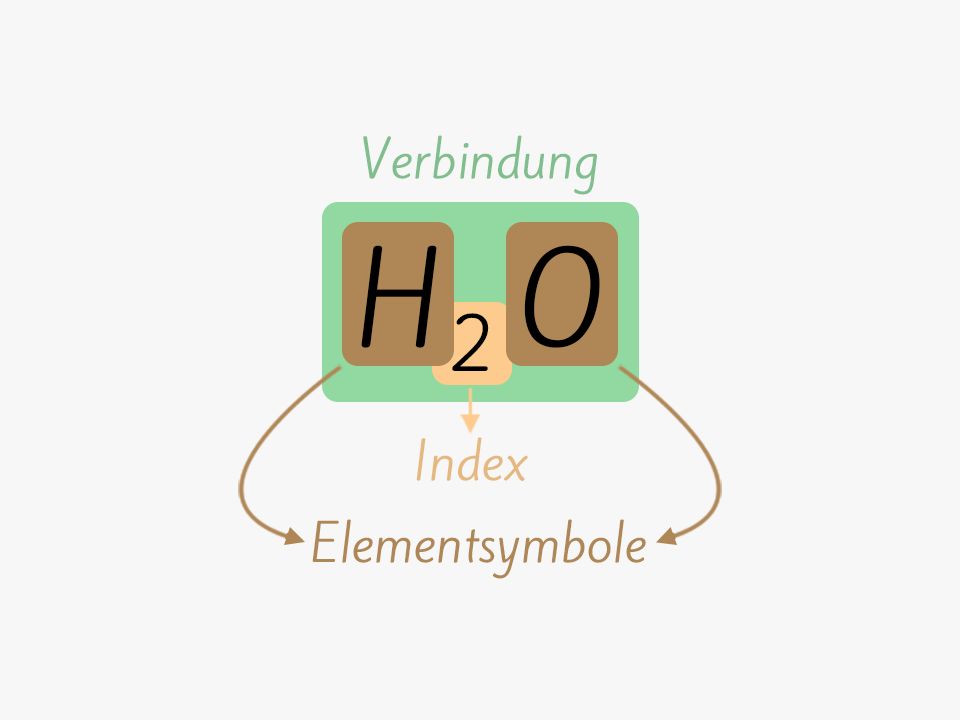
Durch diese Schreibweise können einzelne Elemente (
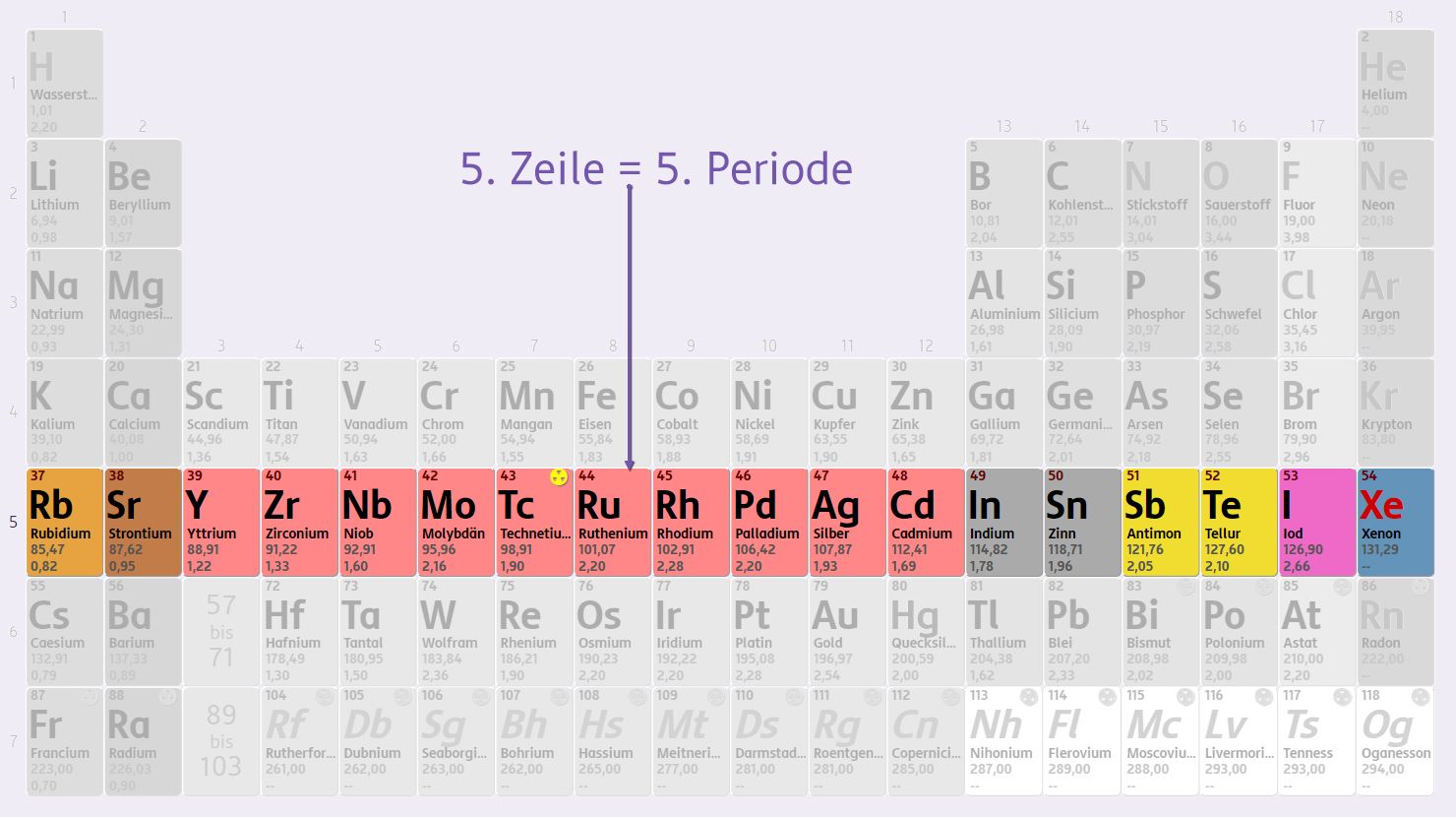
Zeilen = Perioden = Schalen
Jede Zeile (auch Periode genannt) entspricht dabei einer Schale der Atomhülle.
Innerhalb einer Periode nimmt die Anzahl der Protonen zu
Spalten = Gruppen
Die Elemente in einer Spalte (Gruppe genannt) haben ähnliche chemische Eigenschaften. Daher tragen die Gruppen im Periodensystem eigene Namen, die einen Hinweis auf gemeinsame Eigenschaften geben können. Die erste Gruppe bezeichnet man (mit Ausnahme von Wasserstoff) als Alkalimetalle, die 2. Gruppe umfasst die Erdalkalimetalle. Die Halogene (17. Gruppe) und Edelgase (18. Gruppe) sind wichtige Vertreter der Nichtmetalle.

Die Gruppen 3 bis 12 werden als Übergangsmetalle bezeichnet. Bei allen anderen Gruppen (Gruppe 1, 2, 13 bis 18) kann man über die Gruppennummer eine Aussage zu den Außenelektronen treffen. Die letzte Ziffer der Gruppe gibt die Anzahl der Außenelektronen an. So ist Sauerstoff in der 16. Gruppe und hat 6 Außenelektronen.
| Gruppe | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| Außenelektronen | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 (Ausnahme He: 2) |
Durchschnittliche Atommasse
Da bei einem Element unterschiedliche Atomtypen (Isotope) mit unterschiedlichen Atommassen vorliegen, ist die durchschnittliche Atommasse als Kommazahl angeführt.
Diese Zahl stellt einen Durchschnittswert der Atommassen aller Isotope eines Elements dar.
Bei der Ermittlung des Wertes wird auch berücksichtigt, in welchem Anteil die jeweiligen Atome auftreten.
Elemente, bei denen ein Isotop stark überwiegt, haben daher einen nahezu ganzzahligen Wert (

Radioaktive Elemente im Periodensystem
Radioaktive Atome haben instabile Kerne, die sich durch das spontane Aussenden von Teilchen in andere Kerne umwandeln.
Gibt es von einem Element keine stabile Form, so wird das Element im PSE mit einem Symbol für Radioaktivität markiert (hier: ☢). Bei vielen Elementen existieren zu den stabilen Atomsorten auch radioaktive Isotope. Beispielsweise gibt es von Kohlenstoff zwei stabile Formen und ein natürliches radioaktives Isotop: $$ \large \ce{ ^{14}_{6}C } $$.
Ein weiteres Beispiel sind die Isotope von Wasserstoff:
Protium $$ \large \ce{ ^{1}_{1}H } $$ und Deuterium $$ \large \ce{ ^{2}_{1}H } $$ sind stabil, Tritium $$ \large \ce{ ^{3}_{1}H } $$ ist radioaktiv.
Die Geschwindigkeit des Zerfalls wird durch die Halbwertszeit (t1/2) angegeben.
Dies ist die Zeitspanne, in der die Hälfte der vorhandenen Atome zerfällt.
Bismut hat eine lange Halbwertszeit (1,9·1019 Jahre), daher spielt seine Radioaktivität in unserer Lebensspanne keine Rolle.
Viele künstliche Elemente hingegen haben eine sehr kurze Halbwertszeit, manche sogar unter einer Sekunde

