Atommodelle im 20. Jahrhundert
Demokrit und Dalton wussten nicht, dass Atome doch teilbar sind! Das Atommodell nach Dalton konnte noch nicht beschreiben, wie Atome in ihrem Inneren aufgebaut sind. Ungefähr 100 Jahre nach ihm lieferten unter anderem Thomson, Rutherford und Bohr wichtige Erkenntnisse dazu.
Info für Lehrende
Mehr zu SchuBu+
Joseph Thomson (1903)
Dalton wusste noch nicht, dass in Atomen geladene Teilchen vorliegen. Joseph Thomson lieferte erste Hinweise dazu. Er wies negativ geladene Teilchen in Atomen nach. Da Atome nach außen hin ungeladen sind, ging er davon aus, dass diese negativ geladenen Teilchen in einer positiv geladenen Masse vorliegen. Nach dieser Vorstellung formulierte er das Rosinenkuchenmodell.


Ernest Rutherford (1911)
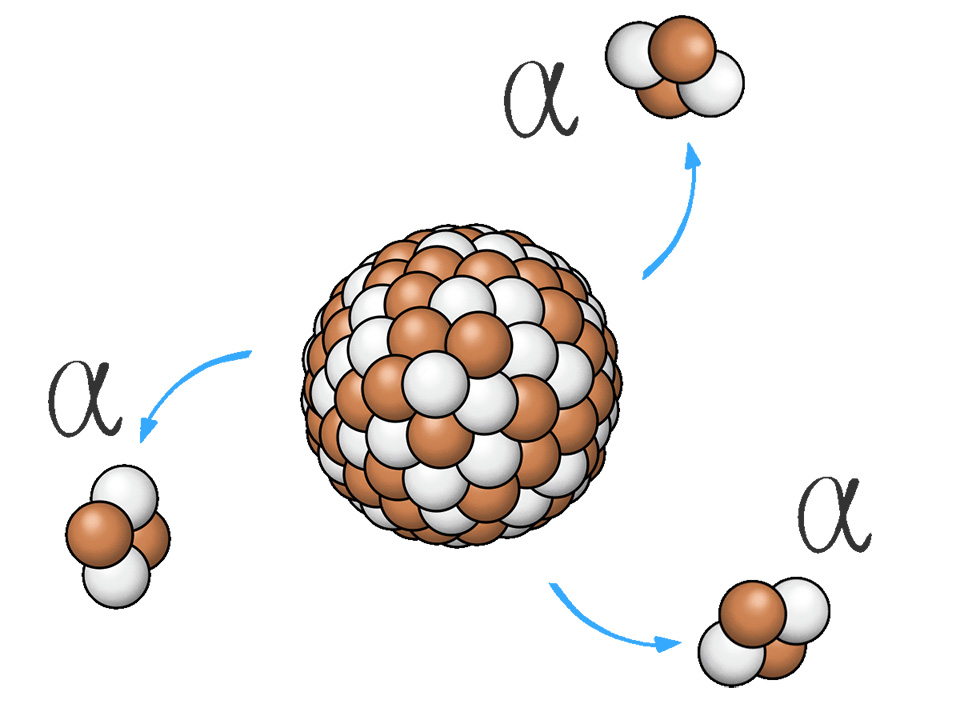
Die Entdeckung der Radioaktivität 1896 durch Antoine Henri Becquerel lieferte die Grundlage für die Erkenntnis, dass Atome nicht unteilbar sind.
Die durch Radioaktivität ausgesendete Strahlung (wie
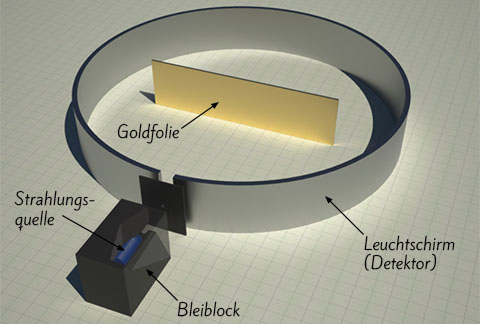
Dabei machte er eine unglaubliche Entdeckung: Der Großteil der Teilchen ging fast ungehindert durch die Folie durch, wenige wurden aber abgelenkt oder reflektiert (zurückgeworfen).

Streuversuch
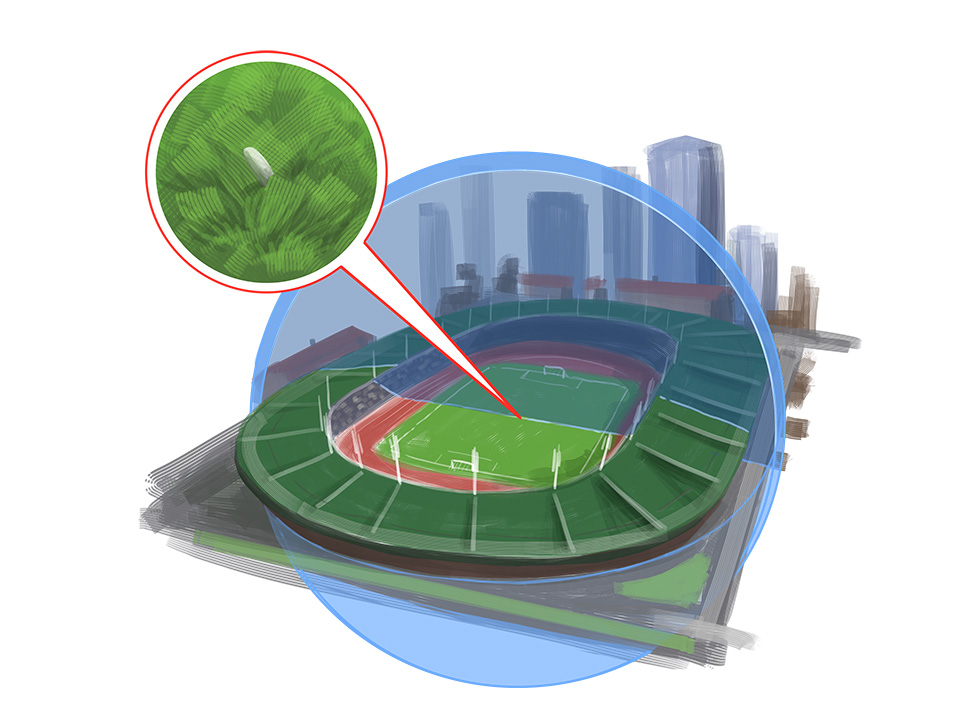
Lust auf ein Experiment? Probiere hier den Streuversuch von Ernest Rutherford selber aus!Daraus schloss Rutherford, dass Atome aus einem sehr kleinen, kompakten Kern und einer vergleichsweise großen, beinahe masselosen Hülle bestehen. Das Größenverhältnis entspricht in etwa einem Reiskorn (Kern) in einem Fußballstadion (Hülle).
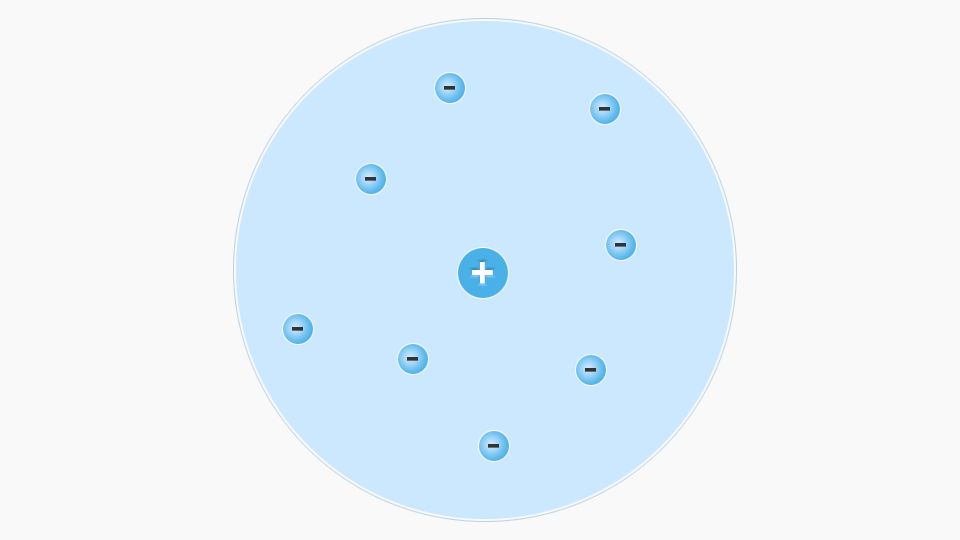
Aus diesen Erkenntnissen entwickelte Rutherford das Kern-Hülle-Modell. Er wusste bereits, dass α-Teilchen positiv geladen sind. Weil bei seinem Versuch einige abgelenkt und keine angezogen wurden, folgerte er daraus, dass der Kern eine positive Ladung haben muss. Da Atome nach außen hin ungeladen sind, konnte er daraus schließen, dass sich in der Hülle negativ geladene Teilchen befinden.

Niels Bohr (1913)
Niels Bohr untersuchte die Hülle von Atomen genauer. Dazu analysierte er folgendes Phänomen:
Hält man Metalle wie Natrium, Lithium oder Barium (gebunden in Salzen zur besseren Handhabung) in eine Brennerflamme, so zeigen die ausgesandten Gase unterschiedliche Färbungen.

Bohr erklärte sich die Flammenfärbung dadurch, dass bei der Energiezufuhr durch Erhitzen Elektronen (negativ geladene Teilchen) in der Hülle auf ein höheres Energieniveau gehoben werden. Fallen sie auf ihre ursprüngliche Bahn zurück, senden sie Energie in Form von Licht einer bestimmten Wellenlänge aus.
Aus diesen Überlegungen hat Bohr das Bohrsche Atommodell entwickelt. Dieses zeigt negativ geladene Elektronen, die auf definierten Bahnen um den positiv geladenen Kern kreisen. Die Elektronen auf den verschiedenen Kreisbahnen haben unterschiedliche Energiestufen. Je weiter außen sich eine Kreisbahn befindet, umso höher ist das Energieniveau.

Das Schalenmodell
Aus den Erkenntnissen von Rutherford und Bohr wurde das Schalenmodell entwickelt. Der positiv geladene Kern ist von Schalen umgeben, in denen sich die Elektronen befinden. Elektronen weiter außen haben ein höheres Energieniveau.

Heute weiß man, dass die Elektronen nicht, wie Bohr dachte, um den Kern kreisen. Daher wird beim Schalenmodell keine Aussage zur Bewegung der Elektronen gemacht.
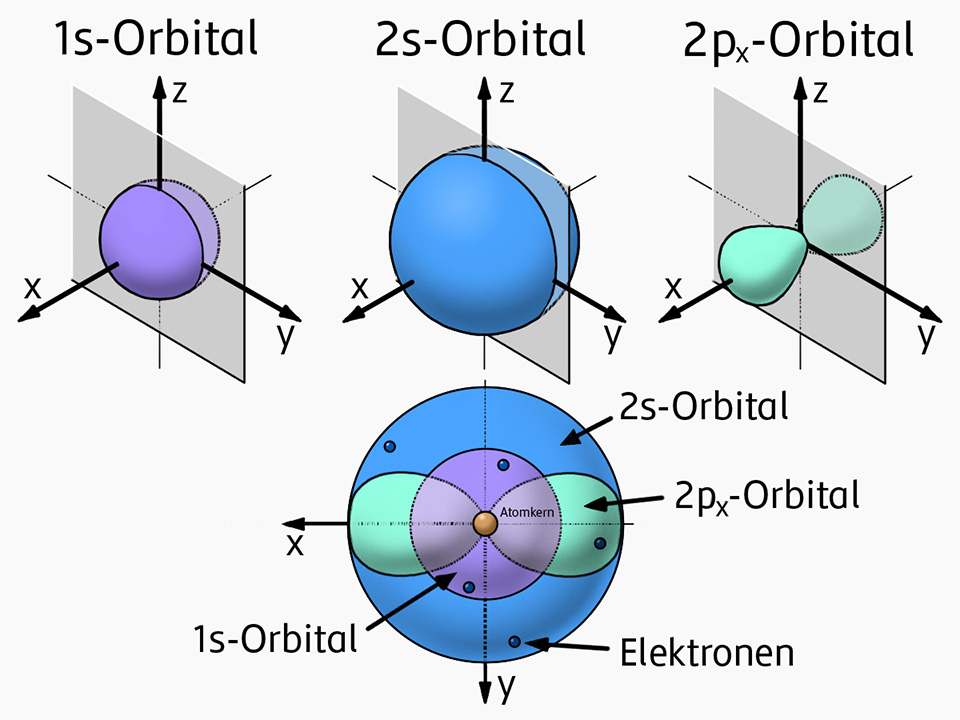
Das Orbitalmodell (1928)
Überlegungen von Erwin Schrödinger, Wolfgang Pauli und anderen Wissenschaftlern haben zur Entwicklung des Orbitalmodells geführt.
Sie erkannten, dass sich die Elektronen in Wirklichkeit nicht in Bahnen um den Kern bewegen.
Vielmehr befinden sich die Elektronen in den Schalen mit einer bestimmten Wahrscheinlichkeit in sogenannten Aufenthaltsräumen (Orbitalen).