Redox-Reaktionen
Bei einer Redox-Reaktion (Reduktions-Oxidations-Reaktion) findet eine Elektronenübertragung auf den Reaktionspartner statt. Bekannte Beispiele sind Verbrennungsreaktionen, das Rosten von Eisen und die Energiegewinnung aus der Nahrung.
Info für Lehrende
Mehr zu SchuBu+
Der Oxidationsbegriff
Im 18. Jahrhundert erforschte der französische Chemiker Antoine de Lavoisier Verbrennungsreaktionen. Er erkannte, dass bei einer Verbrennung die vorliegende Substanz eine Verbindung mit Sauerstoff eingeht. Daraus formulierte er die Oxidationstheorie, die er auf Verbrennungen, aber auch auf andere Vorgänge, anwendete.
| 4 Fe | + | 3 O$$_2$$ | 2 Fe$$_2$$O$$_3$$ | |
|---|---|---|---|---|
| Eisen | Sauerstoff | Eisenoxid | ||
| C | + | O$$_2$$ | CO$$_2$$ | |
| Kohlenstoff | Sauerstoff | Kohlenstoffdioxid |

Redox-Reaktionen genauer betrachtet
Durch weitere Erkenntnisse und das Atommodell nach Bohr konnte Anfang des 20. Jahrhunderts veranschaulicht werden, dass bei Reaktionen wie einer Verbrennungsreaktion Elektronen übertragen werden. So wurden die Begriffe Reduktion und Oxidation definiert.
Bei einer Redox-Reaktion werden Elektronen auf den Reaktionspartner übertragen. Die Oxidation beschreibt dabei die Elektronenabgabe, die Reduktion die Elektronenaufnahme.
Betrachten wir dazu die Verbrennung von Magnesium genauer! Dabei werden die Außenelektronen von Magnesium auf Sauerstoff übertragen. Magnesium wird dabei oxidiert (gibt Elektronen ab), Sauerstoff wird reduziert (nimmt Elektronen auf). Bei dieser Reaktion ist Magnesium das Reduktionsmittel, Sauerstoff ist das Oxidationsmittel.
Die Definitionen werden auch auf Reaktionen, bei denen kein Sauerstoff beteiligt ist, angewendet. Betrachte die Reaktion von Natrium mit Chlor zu Natriumchlorid (Kochsalz)! Bestimmt kannst du die Beschreibungen richtig zuordnen.
Chemiker*innen verdeutlichen die Elektronenübertragung, indem sie eine Reaktion in Teilreaktionen, getrennt nach Oxidation und Reduktion, anschreiben. Beim Ausgleichen einer Reaktion muss berücksichtigt werden, dass bei der Teilreaktion der Oxidation so viele Elektronen abgegeben werden, wie bei der Reduktion aufgenommen werden.
Luca hat versucht, die Teilreaktionen zur Reaktionsgleichung „Calcium reagiert mit Chlor“ aufzustellen, dabei sind ihm aber 7 Fehler unterlaufen. Wie gut kennst du dich bereits mit den Inhalten aus? Überprüfe folgende Übersicht und korrigiere die Fehler!
Beispiele für Redox-Reaktionen
Verbrennungsreaktionen sind schnelle Redox-Reaktionen. Wie du bereits weißt, braucht jede Verbrennung Sauerstoff. Wenn nicht ausreichend Sauerstoff zum Ort der Verbrennung gelangt, spricht man von einer unvollständigen Verbrennung. Dabei können Nebenprodukte wie Ruß und Kohlenstoffmonoxid (ein Atemgift) entstehen.

Langsame Redox-Reaktionen liegen beispielsweise beim Rosten von Eisen (bzw. Korrodieren von Metallen), bei der Verrottung von Bioabfällen und bei der Gewinnung von Energie aus Traubenzucker in unseren Körperzellen vor.


Korrosionsschutz
Metalle sind unterschiedlich korrosionsbeständig. Um Materialien vor der Einwirkung von Wasser, Sauerstoff und korrosionsfördernden Sustanzen (wie Säuren) zu schützen, kann man sie mit einer dünnen Metallschicht überziehen. Häufig werden Armaturen für Badezimmer und Küchen verchromt. So wird das darunter liegende Material (meist Eisen) vor Korrosion geschützt – und es sieht gut aus. Dachrinnen sind oftmals mit einer Zinn- oder Zinkschicht überzogen.


Beim Galvanisieren wird der Vorgang der Elektrolyse angewendet. Dabei wird die Elektronenübertragung durch das Anlegen von Gleichstrom erzwungen. In einer Lösung liegen Ionen des Elements, das als Überzug dienen soll, vor. Auf der Oberfläche des Materials, das galvanisiert wird, nehmen die Ionen Elektronen auf und lagern sie so als metallisches Element ab.
Galvanisiere selbst Gegenstände!
Elektrolyse
Neben der Galvanisierung wird die Elektrolyse beispielsweise zur Gewinnung von Metallen (aus Salzlösungen) oder anderen Stoffen (z. B. Chlor, Wasserstoff, Sauerstoff) oder zur Reinigung von Metallen angewendet.
Bei der Elektrolyse wird durch elektrischen Strom eine Redox-Reaktion erzwungen.
Beispielsweise können durch Elektrolyse elementares Kupfer und Chlorgas aus einer Kupfersulfatlösung (CuCl2) gewonnen werden.
Cu2+ + 2 Cl- Cu + Cl2
Wasser kann durch Elektrolyse in seine Elemente Wasserstoff und Sauerstoff zerlegt werden. Im 19. Jahrhundert hat August Wilhelm Hofmann dazu eine Apparatur entwickelt, die die Wasserelektrolyse veranschaulicht.

Hofmannscher Apparat
Klicke auf eine der markierten Stellen, um die Vorgänge stark vereinfacht im Teilchenmodell zu beobachten!Hier findest du die Anleitung, um eine kleine Elektrolyseapparatur selbst zu bauen!
Elektrochemie
Überlege, in welchen Gegenständen man Batterien und Akkus (Akkumulatoren) verwendet! Kannst du dir einen Alltag ohne diese vorstellen?


Grundlage für Batterien und Akkumulatoren ist eine elektrochemische Zelle (galvanisches Element), das aus 2 unterschiedlichen Metallen als Elektroden besteht. Diese sind in eine Elektrolytlösung (Salzlösung) getaucht, räumlich getrennt und elektrisch leitend miteinander verbunden. Dadurch wird chemische Energie in elektrische Energie umgewandelt.
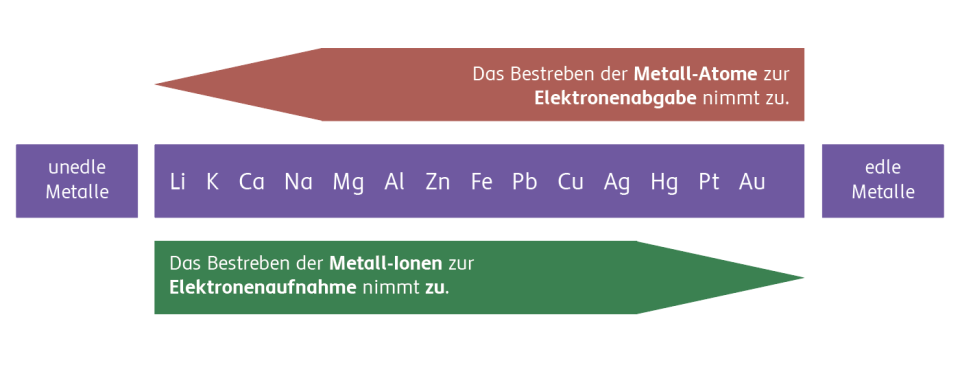
Metalle haben ein unterschiedliches Bestreben, Elektronen abzugeben bzw. aufzunehmen. Je höher das Bestreben, Elektronen aufzunehmen, umso edler ist ein Metall. Der Stromfluss liegt daher immer vom unedleren zum edleren Metall vor.
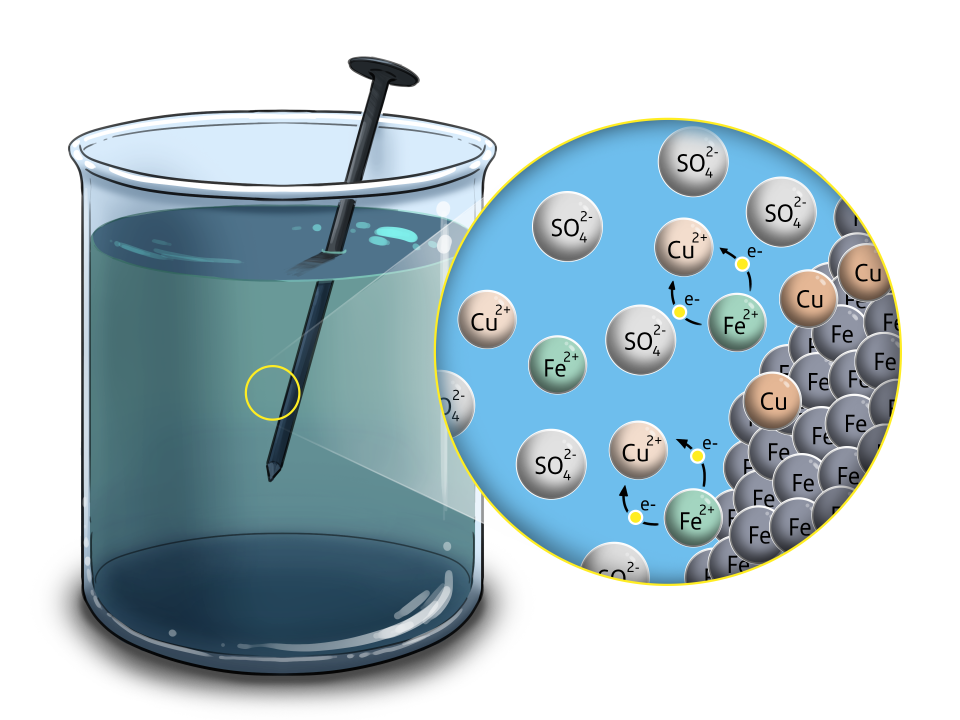
Mit diesem Wissen kann beispielsweise Eisen mit einer Kupferschicht überzogen werden. Gibt man einen Eisennagel in eine Lösung mit Kupfer-Ionen, gibt Eisen an seiner Oberfläche Elektronen an die Kupfer-Ionen ab – somit lagert sich metallisches Kupfer am Eisennagel ab.