Säure-Base-Reaktionen
Bei Säure-Base-Reaktionen werden Wasserstoff-Ionen (H+-Ionen) übertragen. Im Alltag begegnen uns saure und basische Lösungen beispielsweise in Lebensmitteln und in Reinigungsmitteln. Der pH-Wert ist ein Maß dafür, wie sauer bzw. basisch eine Lösung ist.
Info für Lehrende
Mehr zu SchuBu+
Säuren und Basen im Alltag
Überlege, wo dir Säuren und Basen im Alltag begegnen! Vor allem in der Küche und im Haushalt hast du mit sauren und basischen Lösungen zu tun.
Auf Lebensmitteletiketten kann man Inhaltsstoffe wie Essigsäure, Zitronensäure oder Milchsäure lesen. Diese bewirken einen sauren Geschmack und machen Lebensmittel länger haltbar. Zitronensäure und Essigsäure eignen sich sehr gut dafür, um Kalkablagerungen in der Küche und im Badezimmer zu entfernen.



Die Natronlauge wird in der Lebensmittelproduktion bei der Herstellung von Laugengebäck eingesetzt. Im Haushalt findet man Basen beispielsweise in Seifen und Waschmitteln.


Eigenschaften von sauren und basischen Lösungen
Saure Lösungen schmecken sauer (das kennt man von Limonaden und Zitronensaft), basische Lösungen fühlen sich seifig an. Aber welche Eigenschaften sind noch typisch für saure und basische Lösungen?
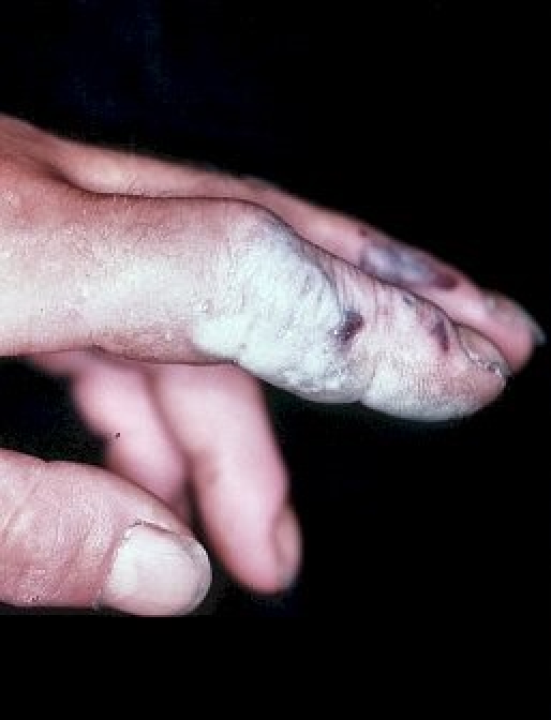
Sie sind ätzend
Saure und basische Lösungen zerstören Gewebe und greifen Oberflächen an. Der Grad der Verätzung hängt dabei von der Konzentration und von der Art der Substanz ab. Säuren schädigen die Zellen an der Hautoberfläche. Basische Lösungen zersetzen organisches Material, sodass dieses dabei verflüssigt. Dadurch kann die schädigende Substanz weiter ins Gewebe eindringen und tieferliegende Schichten zerstören.

Saure Lösungen noch genauer kennenlernen
Hier kannst du weitere Eigenschaften saurer Lösungen noch genauer untersuchen. Wie reagieren Säuren mit Metallen oder mit Kalk?
Säure-Base-Reaktionen
Bei Säure-Base-Reaktionen findet eine Übertragung von Protonen (Wasserstoff-Ionen, H$$^+$$-Ionen) statt. Man spricht daher auch von Protolyse. Ein H$$^+$$-Ion besteht nur aus einem Proton, da sich der Kern eines Wasserstoff-Atoms (dieser besteht aus einem p+) abspaltet, das Elektron bleibt beim Bindungspartner zurück.
Säuren sind Teilchen, die Protonen liefern, man bezeichnet sie als Protonendonatoren.
Im Wasser werden Protonen auf Wasser-Moleküle übertragen, es bleibt ein negativ geladener Säurerest zurück. Es entstehen Oxonium-Ionen (H3O$$^+$$-Ionen), die für die sauren Eigenschaften der Lösung verantwortlich sind. Im folgenden Beispiel wird das Proton von Chlorwasserstoff (HCl) auf ein Wasser-Molekül übertragen, es entsteht Salzsäure.
Basen sind Teilchen, die Protonen aufnehmen, sie sind Protonenakzeptoren.
In Wasser werden Protonen von Wasser-Molekülen übertragen, es bleiben negativ geladene Hydroxid-Ionen (OH$$^-$$-Ionen) zurück. Sie sind für die basischen Eigenschaften verantwortlich. Reagiert Ammoniak (NH$$_3$$) in Wasser, bildet sich Ammoniakwasser.
Die Rolle von Wasser
Wasser spielt bei Säure-Base-Reaktionen eine wichtige Rolle. Saure bzw. basische Lösungen bilden sich, weil Säuren bzw. Basen in Wasser reagieren. Wie man in den obigen Abbildungen sieht, ist Wasser dabei – abhängig vom Reaktionspartner – ein Protonenakzeptor oder ein Protonendonator. Man bezeichnet Wasser daher als Ampholyt.
Wasser kann sogar mit sich selbst reagieren, man spricht von Autoprotolyse. Dabei reagieren sehr wenige Wasser-Moleküle (abhängig von der Temperatur) durch Übertragung von Protonen.
Leitungswasser leitet elektrischen Strom, da sich darin gelöste Salze befinden. Die dadurch vorliegenden Ionen bewirken den Stromfluss. Aber wie ist es bei entionisiertem (also chemisch reinem) Wasser? Nimm dazu Abbildung 4 zu Hilfe! Leitet entionisiertes Wasser Strom?
In reinem Wasser ist nur bei sehr genauen Messungen ein sehr geringer Stromfluss nachweisbar. Das liegt daran, dass sich durch die Autoprotolyse des Wassers eine geringe Menge an Ionen bilden, die im Wasser frei beweglich sind. Diese bewirken den Stromfluss.
Formeln und Namen
Säuren
Die Formeln anorganischer Säuren haben immer den gleichen Aufbau. Salpetersäure ist eine einprotonige Säure (da sie ein H-Atom beinhaltet). Jeder Säurerest (hier: NO$$_3$$$$^-$$) hat eine eigene Bezeichnung. NO$$_3$$$$^-$$ ist das Nitrat-Ion.
Formeln von organischen Säuren wie der Essigsäure (Ethansäure, CH$$_3$$COOH) haben einen speziellen Aufbau. Du erkennst sie an der COOH-Gruppe in der Formel. Bei organischen Säuren wird immer ein Proton der COOH-Gruppe abgespalten. Der Säurerest der Essigsäure ist
Lerne hier gängige Säuren genauer kennen!
| Formel | Bezeichnung in Lösung | Säurerest | Bezeichnung des Säurerests | Vorkommen / Verwendung |
|---|---|---|---|---|
| HCl | Salzsäure | Cl- | Chlorid-Ion | Magensaft, Industrie |
| HNO3 | Salpetersäure | NO3- | Nitrat-Ion | Herstellung von Düngemitteln |
| HF | Flusssäure | F- | Fluorid-Ion | Herstellung von Computerchips |
| H2SO4 | Schwefelsäure | SO42- | Sulfat-Ion | sehr wichtig für die industrielle Produktion |
| H2CO3 | Kohlensäure | CO32- | Carbonat-Ion | Getränkeherstellung |
| H3PO4 | Phosphorsäure | PO43- | Phosphat-Ion | Lebensmittelindustrie (z. B. in Cola-Getränken) |
| CH3COOH | Essigsäure | CH3COO- | Acetat-Ion | Salatmarinade, Lebensmittelindustrie |
Leitet man Kohlenstoffdioxid in Wasser ein, reagiert ein kleiner Teil (weniger als 0,5 % des eingeleiteten CO2) mit Wasser zu Kohlensäure (H2CO3). Der Rest des CO2 liegt im Wasser gelöst vor und erzeugt damit die bekannten Gasbläschen im Sodawasser. Die entstandene Kohlensäure (H2CO3) zerfällt in Ionen. Dabei werden pro Molekül zwei Protonen auf Wasser-Moleküle übertragen, es entstehen H3O+-Ionen. Die Oxonium-Ionen machen Sodawasser leicht sauer.
Basen
Formeln von Basen erkennt man am Metallatom
Lerne hier gängige Basen genauer kennen!
| Formel | Name | Bezeichnung in Lösung | Verwendung |
|---|---|---|---|
| NaOH | Natriumhydroxid | Natronlauge | Abflussreiniger |
| KOH | Kaliumhydroxid | Kalilauge | Herstellung von Seifen und Farbstoffen |
| Ca(OH)2 | Calciumhydroxid | Kalkwasser | zur Analyse (Nachweis von CO2) |
| NH3 | Ammoniak | Ammoniakwasser | Reinigungsmittel |

Säure-Base-Hüpfen
Lass das Formel-Känguru zu den richtigen Namen springen und erfahre so mehr über ihre Verwendung!Ordne Bezeichnung und Verwendung der Säuren und Basen richtig zu!
Neutralisation
Mischt man saure und basische Lösungen miteinander, kommt es zur Neutralisationsreaktion. Dabei reagieren die H3O+-Ionen und die OH--Ionen zu Wasser-Molekülen. Die Neutralisationsreaktion ist eine exotherme Reaktion, es wird dabei Energie frei.
Werden die Lösungen dabei im richtigen Verhältnis zueinander verwendet, entsteht eine neutrale Lösung. Im folgenden Beispiel reagieren Salzsäure (HCl(aq)) und Natronlauge (NaOH(aq)) miteinander. Dabei entsteht eine neutrale Kochsalzlösung.

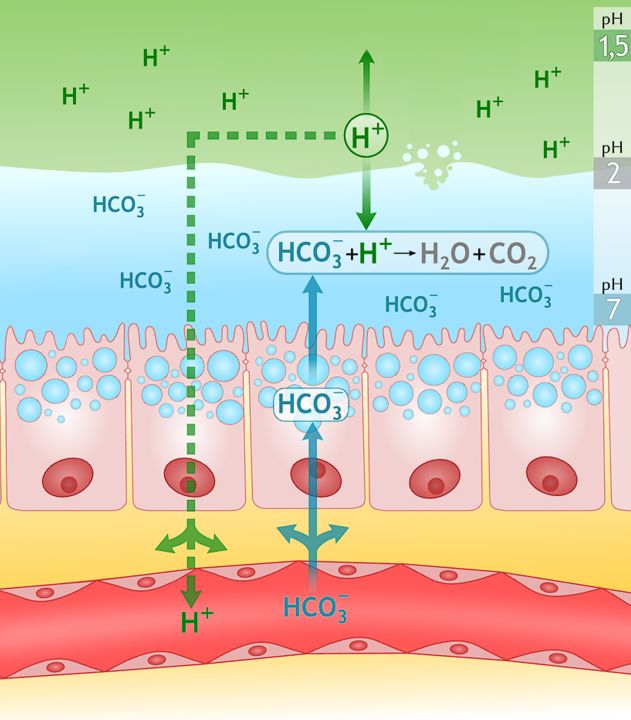
In unserem Körper finden überlebenswichtige Neutralisationsreaktionen statt. Der Magensaft, der von Drüsen in der Magenschleimhaut produziert wird, beinhaltet Salzsäure. Hast du dich schon einmal gefragt, warum unsere Magenwand nicht vom Magensaft zersetzt und verdaut wird? Das liegt daran, dass die Magenschleimhaut eine dicke schützende Schleimschicht produziert. Diese beinhaltet HCO3--Ionen (Hydrogencarbonat, Anionen der Base NaHCO3). Sie neutralisieren die H3O+-Ionen der Salzsäure. Im Zwölffingerdarm sorgen HCO3--Ionen für eine basische Umgebung, im Blut schützen sie vor Übersäuerung.
pH-Wert und Indikatoren
Ein Maß für die Konzentration der frei vorliegenden H3O+-Ionen ist der pH-Wert. Damit kann angegeben werden, ob eine Lösung sauer, neutral oder basisch ist. Die pH-Skala reicht von 0 bis 14. Neutrale Lösungen haben einen pH-Wert von 7. Je saurer eine Lösung ist, umso geringer ist der pH-Wert. Je basischer die Lösung ist, umso höher ist der pH-Wert.

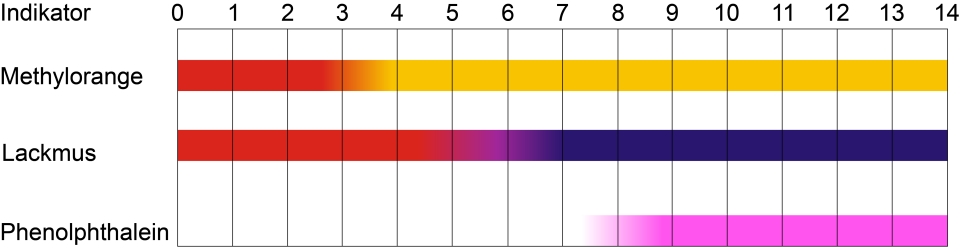
Der pH-Wert kann mit einem pH-Meter gemessen werden. Mit einem Indikator wird der pH-Wert einer Lösung abgeschätzt. Indikatoren sind Farbstoffe, deren Farbe sich in Abhängigkeit des pH-Wertes ändert. Indikatoren werden als Flüssigindikator oder als Teststreifen eingesetzt.



Im Labor kommen Mischungen an Indikatorsubstanzen (Universalindikatoren) oder einzelne Substanzen zum Einsatz. Die Farbskala zeigt, dass sich Phenolphtalein für den Nachweis stark basischer Lösungen eignet. Methylorange hingegen wird beim Nachweis von stark sauren Lösungen eingesetzt. Es gibt aber auch Naturstoffe wie Schwarztee, Malventee oder Rotkrautsaft, die als Indikatoren eingesetzt werden können.


Möchtest du Indikatoren selbst herstellen und anwenden? Hier findest du wichtige Tipps dazu!
Finde heraus, welche pH-Werte Alltagsprodukte aufweisen!