Grundlagen chemischer Reaktionen
Die Zufuhr von Aktivierungsenergie führt zum Ablauf einer chemischen Reaktion. Im Laufe der Reaktion können Energieumsätze, oftmals durch Freisetzung oder Verbrauch von Wärmeenergie, beobachtet werden. Die Geschwindigkeit einer Reaktion kann durch Temperatur, Druck oder einem Katalysator beeinflusst werden.
Info für Lehrende
Mehr zu SchuBu+
Die Energie macht’s!
Bei allen chemischen Reaktionen finden Energieumwandlungen statt. Oftmals ist bei einer Reaktion frei werdende Energie in Form von Wärme zu beobachten. Wärmeenergie nutzen wir beispielsweise beim Heizen oder Kochen. Daneben setzen manche Reaktionen Energie in Form von Geräuschen (erinnere dich an die Knallgasreaktion) oder in Form von Licht (beispielsweise bei Kerzen oder einem Feuerwerk) frei.


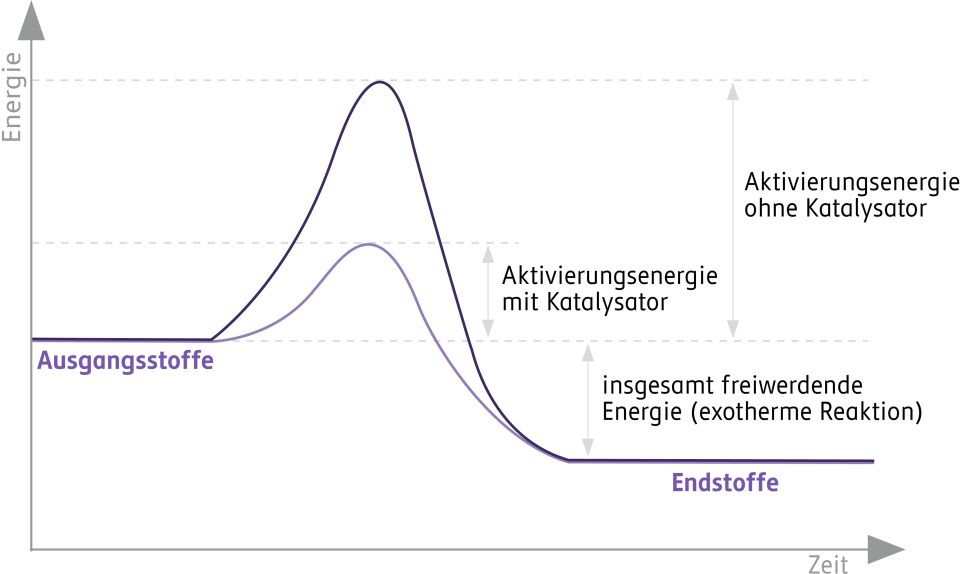
Damit eine chemische Reaktion ablaufen kann, muss Aktivierungsenergie überwunden werden.
Die Aktivierungsenergie ist die Energie, die notwendig ist, damit eine chemische Reaktion abläuft.
Die Aktivierungsenergie kann man damit vergleichen, dass beim Start einer Schlittenfahrt die Haftreibung überwunden werden muss, zum Beispiel durch Antauchen mit den Füßen, um den Berg hinunter gleiten zu können. Eine brennende Kerze setzt Energie in Form von Wärme und Licht frei, davor muss man sie aber anzünden (also Aktivierungsenergie zuführen). Reibt man einen Streichholzkopf an der Reibefläche, werden durch die Reibungsenergie chemische Reaktionen in Gang gesetzt. Diese führen zum Entzünden des Streichholzes.



Die benötigte Energiezufuhr hängt von dem Energieberg der Aktivierungsenergie ab.
Folgendes Experiment veranschaulicht die Aktivierungsenergie.
Reaktionen wie Verbrennungen benötigen zwar Aktivierungsenergie, setzen dann aber im Laufe der Reaktion Wärme frei. Man spricht dabei von exothermen Reaktionen. Es gibt aber auch endotherme Reaktionen, die für den Ablauf (nicht nur für die Aktivierung) Energie benötigen. Endotherme Reaktionen spielen in der chemischen Industrie eine wichtige Rolle (z. B. wird zur Gewinnung von Eisen aus Eisenoxid hohe Temperaturen benötigt). Sie begegnen dir auch im Alltag: beispielsweise musst du beim Kochen Energie zuführen, damit sich Lebensmittel verändern (z. B. beim Braten eines Eis).
Auch bei Lösungsvorgängen gibt es einen Energieumsatz. Probiere es aus!
Reaktionsgeschwindigkeit
Reaktionen verlaufen unterschiedlich schnell. Verbrennungsreaktionen sind sehr schnelle Reaktionen, das Rosten von Eisen und das Verwittern von Gestein hingegen verlaufen langsam.



Eine Reaktion zwischen Teilchen kann nur erfolgen, wenn diese wirksam zusammenstoßen. Durch die Veränderung von Druck, Temperatur und der Konzentration der beteiligten Substanzen kann man die Reaktionsgeschwindigkeit beeinflussen. Probiere es selbst aus!
Je öfter Teilchen wirksam aufeinandertreffen, umso schneller werden Endstoffe gebildet. Die Reaktionsgeschwindigkeit kann daher erhöht werden durch…
- Temperaturerhöhung, da die Teilchen sich schneller bewegen.
- Druckerhöhung, da sich dadurch die Konzentration der Teilchen erhöht (gleiche Teilchenzahl in einem geringeren Volumen).
- Zugabe von Ausgangsstoffen, da sich dadurch die Konzentration der Teilchen erhöht.
Die Voraussetzung für den Ablauf einer chemischen Reaktion ist das Zusammentreffen der beteiligten Teilchen. Liegt eine (oder mehrere Substanzen) als Feststoff vor, spielt daher auch die Oberfläche eine wichtige Rolle. Feinkörnige Strukturen haben eine größere Oberfläche, an der es zu Reaktionen kommen kann.

Überlege, was wir im Alltag oder im Labor machen, um eine Reaktion zu beschleunigen!
Genau! Durch erwärmen, rühren und schütteln kann die Reaktionsgeschwindigkeit erhöht werden, da dadurch die Teilchen schneller aufeinander treffen.
Katalysatoren sind eine weitere Möglichkeit, um die Reaktionsgeschwindigkeit zu erhöhen. Sie finden in unserem Körper, im Labor und in der Technik Anwendung. Katalysatoren setzen die Aktivierungsenergie herab und beschleunigen damit den Ablauf einer Reaktion. Katalysatoren werden bei der Reaktion nicht verbraucht.
In unserem Körper finden sich Biokatalysatoren (Enzyme), die eine Vielzahl an Vorgängen ermöglichen. Beispielsweise ermöglichen Verdauungsenzyme die Zerkleinerung von Nahrung. Die Nahrungsbestandteile können dadurch in den Blutkreislauf aufgenommen und an ihren Wirkort transportiert werden. Mit folgendem Experiment kannst du Enzyme in Kartoffeln kennenlernen!
Der Begriff Katalysator ist dir vielleicht von Autos bekannt. Der Abgaskatalysator (mit einer Schicht aus Platin, Palladium oder Rhodium) ermöglicht die Umwandlung von Giftstoffen (wie Kohlenstoffmonoxid, CO und Stickstoffmonoxid, NO), die bei der Verbrennung von Benzin entstehen können. Dadurch wird der Ausstoß an Schadstoffen verringert.

