Die Chemische Wirkung des elektrischen Stroms
Kann man den Prozess, der in den galvanischen Zellen abläuft, auch umkehren? Elektrolyse und Galvanisieren sind zwei weit verbreitete Anwendungen der chemischen Wirkung des elektrischen Stroms.
Info für Lehrende
Mehr zu SchuBu+
Mit Strom Chemie erzwingen
Seit der Entwicklung kontinuierlicher Spannungsquellen durch Allesandro Volta konnte auch die chemische Wirkung des elektrischen Stroms erforscht werden.
Schon bald war klar, dass die Vorgänge, die in einer galvanischen Zelle von selbst stattfinden, auch umgekehrt werden können. Statt wie im galvanischen Element chemische Energie in elektrische Energie umzuwandeln, werden bei der Elektrolyse mit Hilfe elektrischer Energie chemische Reaktionen erzwungen. Diese Entdeckungen führten zu zahlreichen Verfahren mit bis heute großer technischer Bedeutung und finden Anwendung in Industrie, Technik und Kunst.
Anwendungsbeispiele
Bei der Gewinnung von Aluminium wird mit Hilfe von elektrischem Strom mittels Schmelzflusselektrolyse in riesigen Anlagen das unedle Metall bei einer Spannung von
In welcher Form taucht Aluminium in deinem Alltag auf? Gehst du Ressourcen schonend damit um?
Zur Herstellung von



Offshore Wasserstoffproduktion: Mit dem elektrischen Strom können auch chemische Verbindungen in ihre Bestandteile zerlegt werden, wie bei der Elektrolyse von Wasser zu Sauerstoff und Wasserstoff.
Bei den Verfahren der Galvanotechnik können Gegenstände entweder mit dünnen Schichten aus Metall überzogen werden

Um besser zu verstehen, wie der elektrische Strom seine chemische Wirkung entfaltet, wird hier exemplarisch die für die Energiewende sehr wichtige Herstellung von Wasserstoff durch Elektrolyse, sowie das Überziehen von Objekten mit dünnen Metallschichten (Galvanisieren) genauer betrachtet.
Elektrolyse von Wasser
Um Leitungswasser in Sauerstoff und Wasserstoff zu zerlegen, gibt man zur Erhöhung der elektrischen Leitfähigkeit Salze ins Wasser. Denn Salze bestehen aus Ladungsträgern. Im Festkörper sind sie in das Kristallgitter eingebunden. Sie können sich nicht frei bewegen. Gelöst in Wasser bilden sie frei bewegliche Ionen und leiten den elektrischen Strom.
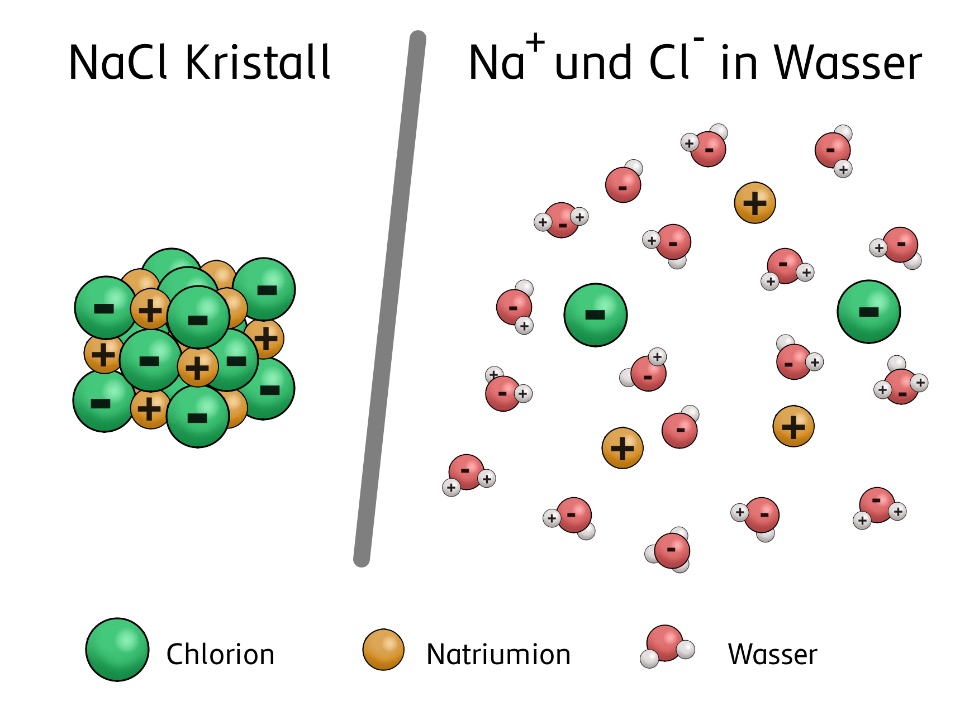
Allerdings ist normales Speisesalz (NaCl) nicht so günstig für die Herstellung von Wasserstoff, da es aus positiven Natrium-Ionen (Na+) und negativen Chlorid-Ionen (Cl-) besteht. Die Chlorid-Ionen stören die Wasserstoffproduktion durch die Bildung von giftigem Chlorgas (Cl2). Das ist auch bei der Wasserstoffproduktion aus Meerwasser ein großes Thema, denn es verursacht höhere Kosten (durch die notwendige Entsalzung) und geringere Wasserstoffausbeute.
Elektrolyse
Was kann beobachtet werden? Wo entsteht Wasserstoff?
Auf der Seite der negativ geladenen Elektrode enstehen Wasserstoff (H2) und Hydroxid-Ionen (OH-).
Auf der Seite der positiv geladenen Elektrode enstehen
Da in diesem Versuch aus flüssigem Wasser (H2O), die Gase Sauerstoff (O2) und Wasserstoff (H2) gebildet werden, entsteht in etwa doppelt so viel Wasserstoff wie Sauerstoff.
Das Gefäß für die Elektrolyse nennt man Elektrolysezelle. Die Elektroden heißen Anode und Kathode. Die Flüssigkeit, die den Strom mit Hilfe von Ionen leitet, heißt Elektrolyt.
Sobald Strom eingeschalten wird, passiert grob vereinfacht folgendes:
- Elektronen wandern vom Minuspol der Spannungsquelle zur negativen Elektrode (Kathode).
- An dieser Elektrode (Kathodereaktion) wird Wasser unter Aufnahme von Elektronen in Wasserstoffgas und OH--Ionen zerlegt.
- An der anderen, positiven Elektrode (Anodenreaktion) werden Elektronen aufgenommen. Dort zerlegt sich Wasser in H+-Ionen und Sauerstoffgas.
- Das Salz in der Elektrolytlösung (hier MgSO4) dient als Ladungsträger, nimmt aber nicht an der Reaktion teil.
Die Elektrolyse von Wasser kannst du sehr leicht selber ausprobieren. Dazu wird statt Speisesalz Bittersalz (Magnesiumsulfat, Epsomsalz, MgSO4) zur Erhöhung der Leitfähigkeit verwendet. Etwas Rotkrautsaft dient uns zum Verdeutlichen der Reaktion an den Elektroden:
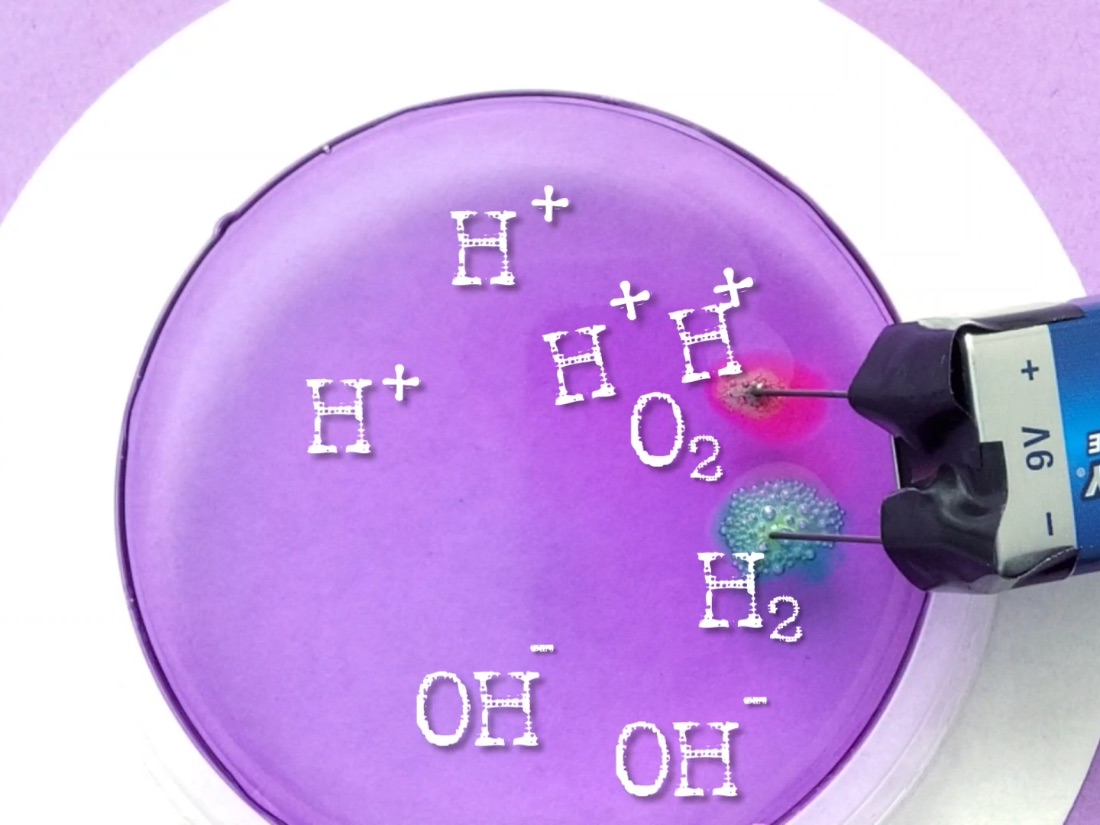
- Rot bedeutet hier sauer. Es entstehen Sauerstoff und ein Überschuß an H+ in der Lösung.
- Grün bedeutet hier basisch. Es entsteht Wasserstoff und ein Überschuß an OH- bildet sich lokal in der Lösung.
Wasserstoff als Energiespeicher
In der technischen Wasserelektrolyse sind hohe Ausbeute (hoher Wirkungsgrad) und wenig Nebenprodukte insbesondere dann wichtig, wenn Wasserstoff als Energiespeicher genutzt werden soll.
Hohe Wirkungsgrade erreicht man durch Optimierung von Temperatur (
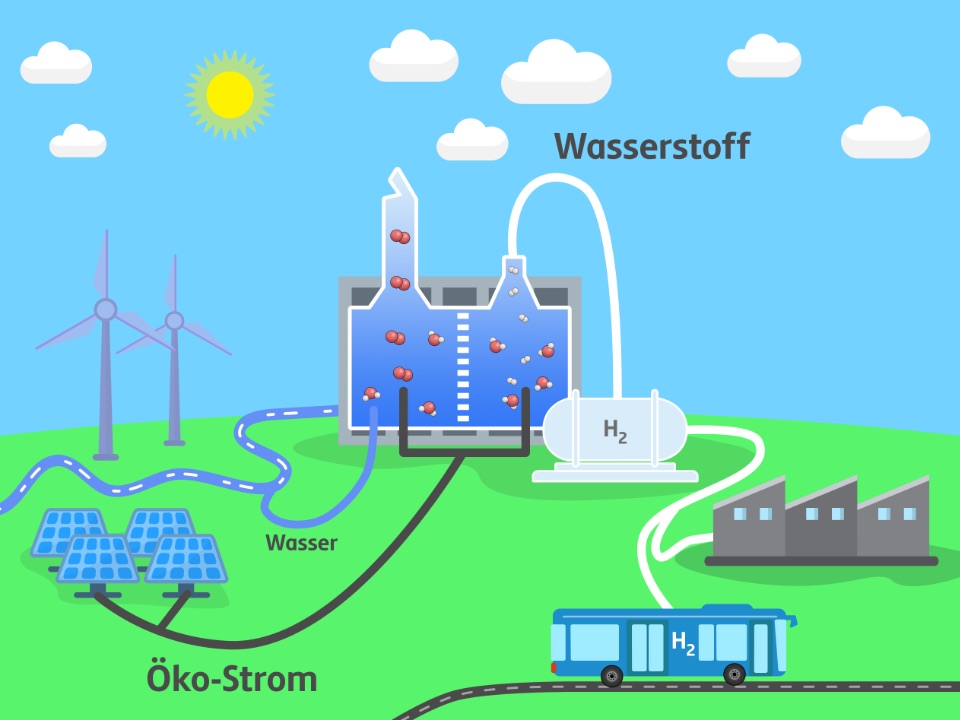
In Wien Simmering entsteht gerade eine Elektrolyseanlage, die ab 2025 die Linienbusse mit Wasserstoff versorgen soll.
Galvanotechnik
Das oberflächliche Überziehen von Metallen oder leitend gemachten Nichtmetallen mit einer dünnen Metallschicht wird Galvanisieren genannt. Das funktioniert im Prinzip ganz ähnlich wie die Elektrolyse. Auch hier werden Bindungen mit Hilfe des elektrischen Stroms neu geknüpft und Material bewegt zwischen den Elektroden durch eine Elektrolytlösung.
Manchmal wird aus dekorativen Gründen (vergolden) galvanisiert, meist soll aber dadurch eine schützende Schicht entstehen, die das darunter liegende Material vor Korrosion (Rosten) schützt. Oft will man auch beides.
Einzelarbeit: Finde 3 Beispiele aus deinem Umfeld, wo eine dekorative oder schützende Schicht aufgetragen wurde.
Info für Lehrende


Verkupfern von Eisen
Verkupfertes Eisen hatte wahrscheinlich jede und jeder schon mal in der Hand

Beim Galvanisieren ist die genaue Zusammensetzung der Lösung für glänzende, haltbare und gleichmäßige Schichten besonders wichtig und oft durch Patente geschützt.
Einfache Anordnung zum Verkupfern von Eisen
Man taucht das Eisenstück in eine Kupfersulfatlösung (Elektrolyt) und verbindet es mit dem Minuspol der Gleichspannungsquelle. Eine Kupferelektrode taucht auch in den Elektrolyt und wird mit dem Pluspol verbunden. Am Eisenstück beginnt eine Kupferschicht zu wachsen, deren Dicke von der Lösung, der Temperatur, der Versuchsdauer und der Stärke des fließenden Stroms abhängt.
Aber: Auch ohne Spannungsquelle überzieht sich das Eisenstück in der Kupfersulfatlösung mit Kupfer – das geht langsamer und Eisen löst sich zeitgleich auf – das nennt man dann Zementation.

